医薬品医療機器等法では、化粧品を業として製造若しくは海外から輸入し、国内
の市場に出荷して、流通・販売させるためには、化粧品の製造販売業と製造業の許
認可が必要です。
製造販売業者により国内の市場への出荷判定がなされ、出荷された後、化粧品を
販売するためには、特に販売許可等を取得する必要はなく、小売店等で自由に販売
できます。

化粧品の製造から販売までの流れ
<目次>
1.化粧品の製造販売業ついて
2.化粧品の製造販売業の許可要件
3.化粧品の製造販売を始める前に
4.化粧品の製造業の許可要件
1.化粧品の製造販売業ついて
- (1)化粧品とは
- 化粧品とは、「人の身体を清潔にし、美化し、魅力を増し、容貌を変え、又は皮膚若しくは毛
髪を健やかに保つために、身体に塗擦、散布その他これらに類似する方法で使用されることが目
的とされている物で、人体に対する作用が緩和なものをいいます。」と定義されます。
- 化粧品はその効能の範囲(56項目)が定められているため、これらを標榜するものは化粧品
とみなされます。一方、上記の定義にそぐわないものや、化粧品の効能の範囲をこえるものは、
医薬品又は医薬部外品に該当する場合があります。
- 化粧品には、添加剤としてのみ使用される成分を除く医薬品の成分を配合してはなりません。
このように、商品に含まれる配合成分に関して、化粧品基準、生物由来原料基準、医薬品医療機
器等法第56条、第62条で定める販売、製造禁止等の基準について、事前に確認・検討すること
が必要になります。
- 化粧品の製造販売を業として行う場合には、製造又は輸入を考えている商品が、医薬品医療機
器等法の「化粧品」として扱うことができるものなのかという点と、申請者として、製造販売業
や製造業の許可を受けるための条件を整えることができるのかという観点から、最初に検討する
必要があります。
(医薬品医療機器等法第2条第3項、「化粧品の効能の範囲の改正について」(平成23年7月
21日 薬食発0721第1号)、「化粧品基準」(平成12年9月29日 厚生省告示331号)ほか
より)
-
- (2)化粧品の製造販売業とは
- 平成17年4月1日から「製造販売業」という新たな許可制度ができました。
化粧品の製造販売業者は、その取扱う製品についての市場に対する責任者を負い、他社に製造
を委託している場合や輸入している化粧品についても、その品質を確保する責任があります。
- 化粧品の製造販売業者は、消費者からの情報や、使用している成分等の情報を広く収集・評価
して、製品の安全性を常に確保する必要があります。必要な場合には健康被害の発生を未然に防
ぎ拡大を防止して消費者を保護するために、製品の回収を行う必要があります。
- 化粧品の製造販売を業として行う場合には、厚生労働大臣の「許可」を受けなければなりませ
ん製造販売業の許可は、5年ごとにその更新を受ける必要があります。
- 製造販売業と製造業は、行うことができる行為が全く異なりますから、製造販売業では、製造
を行うことができません。
化粧品を国内で製造することにより、国内の市場に出荷し、流通させるためには、「化粧品製
造業許可(許可区分:一般)」および「化粧品製造販売業許可」が必要です。
化粧品を海外から輸入することにより、国内の市場に出荷し、流通させるためには、「化粧品
製造業許可(許可区分:包装・表示・保管)」および「化粧品製造販売業許可」が必要です。
- <化粧品の製造販売の手続き全般の関係図>
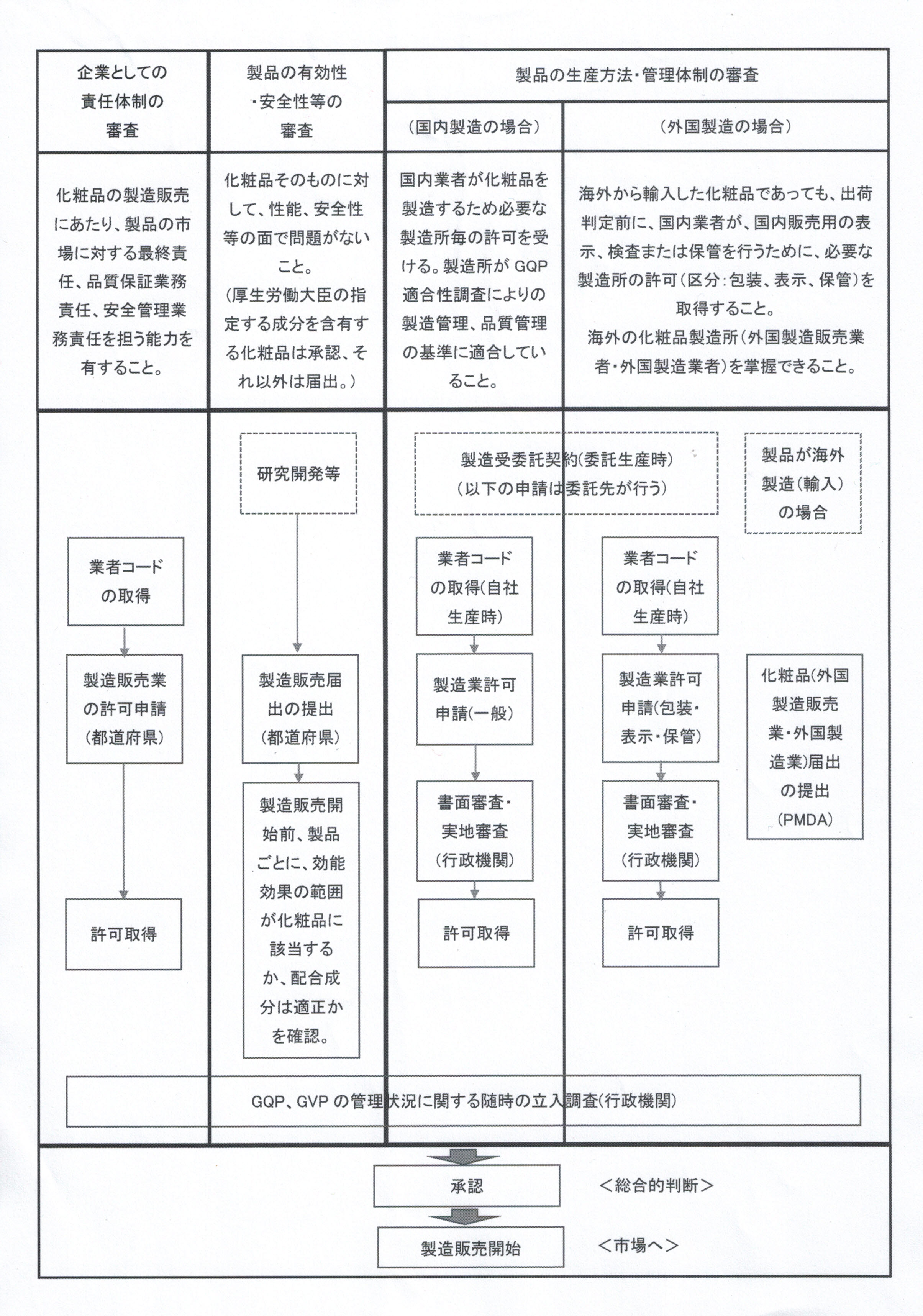
- <医薬品、医薬部外品又は化粧品の種類に応じた製造販売業の許可の種類>
-
医薬品、医薬部外品又は化粧品の種類
|
許可の種類
|
医薬品医療機器等法の第49条第1項に規定する厚生
労働大臣の指定する医薬品
|
第一種医薬品製造販売業許可
|
前項に該当する医薬品以外の医薬品
|
第二種医薬品製造販売業許可
|
医薬部外品
|
医薬部外品製造販売業許可
|
化粧品
|
化粧品製造販売業許可
|
-
- (3)製造販売の届出
- 化粧品(厚生労働大臣の指定する成分を含有する化粧品を除く。)の製造販売を業として行う
場合には業としての「製造販売業許可」とは別に、あらかじめ、品目ごとに、厚生労働省令で定
めるところにより、厚生労働大臣に、製造販売を行う化粧品についての「製造販売届出」をしな
ければなりません。製造販売届出書は当該製造販売業者の主たる機能を有する事務所の所在地の
都道府県知事あて提出することとされています。
(医薬品医療機器等法第14条第の9より)
-
- (4) 化粧品の輸入手続き
- 化粧品は、医薬品医療機器等法の規制対象のため、製造販売業の許可なしには輸入できません
化粧品を海外から輸入して、国内販売を行う場合には、以下の許認可等の手続きが必要になりま
す。
- 化粧品を輸入して販売するには、化粧品製造販売業の許可を取得する必要があります。海外か
らの化粧品の輸入者の責務は、国内製造販売業者と同格です。
海外から輸入した化粧品であっても、出荷判定前に、国内販売用の表示、検査または保管を行
うために、化粧品製造業(包装・表示・保管)の許可を取得する必要があります。
- 化粧品を輸入して販売するには、海外化粧品製造所の掌握の手続きとして輸入しようとしてい
る化粧品に係る「化粧品(外国製造販売業者、外国製造業者)届書」を提出する必要があります
(提出先はPMDA)
また、上記の「化粧品外国届」とともに、販売品名ごとに名称、成分及び分量又は本質、製造
方法その他、外国製造所、国内製造所(保管等)に関する情報を報告するため、「(化粧品)製
造販売届出」を提出する必要があります。(提出先は都道府県知事)
更に、表示義務その他の確認が必要です。平成28年1月1日より輸入届は廃止されました。
- このほか、関税法(知的財産権侵害物品)により、偽ブランド商品など知的財産権(商標権、
著作権、著作隣接権、 特許権、実用新案権、意匠権)を侵害する物品の輸入は禁止されていま
す輸入者が偽物と知らなかった場合であっても侵害物品として輸入が差止められます。
登録認証機関による指定管理医療機器の認証に際して、工業標準化法によるJIS規格への適合
が求められることがあります。
(医薬品医療機器等法の第80条第6項、同施行令第76条第2項ほかより)
2.化粧品の製造販売業の許可取得の要件について
- 医療機器等の製造販売業許可取得の要件は、以下の3つです。
<2-1> GQP省令への適合
<2-2> GVP省令への適合
<2-3> 人的要件・その他の順守事項
許認可の申請手続きの要領は、以下を参照ください。
<2-4> 化粧品製造販売業許可の申請手続き要領
<2-1> GQP省令への適合
- 製造販売業者は、製造販売する製品について、適正な品質を確保するために、法(GQP省令)に
定る基準に従って、品質管理に関する業務を行う必要があります。
- (1)GQP省令とは
- 「医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令(平成
16年厚生労働省令第136号)」(全4章21条)という、製造販売業の許可要件となる医薬品等の
品質管理の方法に関する基準法令で、製造販売業の許可要件として制定された厚生労働省令です
「GQP(Good Quality Practice) 省令」と略称します。
- 医薬品等(原薬除く)の製造販売をするにあたり必要な製品の品質を確保するために行う、以
下のような業務手順について規定しています。
(ア)医薬品等の市場への出荷の管理(ルール)。
(イ)製造所(製造業者・外国製造業者)の適正な製造管理及び品質管理の確保(ルール)。
(ウ)品質等に関する情報及び品質不良等の処理(ルール)。
(エ)品質不良による回収処理(ルール)。
(オ)自社の業務内容の自己点検(ルール)。
(カ)製造販売の業務関係者に対する教育訓練(ルール)。
(キ)文書や記録の管理(保存方法や保存年限、改訂履歴等のルール)。
(ク)品質部門と安全部門あるいは営業部門など各部門との連携。
(ケ)個別製品の品質標準書の整備(製品の規格や試験検査方法、成分や配合量、製造方法や製
造所の情報、表示内容、保管条件、輸送条件等のルール)。
(コ)製造業者との取り決め(製造業務の範囲・製造管理及び品質管理の方法・出荷手順、製造
方法の技術的条件・変更時の連絡方法等の定め)。
- なお、化粧品の製造販売業の許可要件としては、以下の内容に関する品質管理業務の手順書の
作成が必要になります。
(A)市場への出荷に係る記録の作成 ・・・(ウ)に関する。
(B)適正な製造管理及び品質管理の確保・・・(エ)に関する。
(C)品質等に関する情報及び品質不良等の処理・・・(オ)に関する。
(D)回収処理 ・・・(カ)に関する。
(E)文書及び記録の管理 ・・・(コ)に関する。
その他、自己点検、教育訓練等についても望ましい。
<2-2> GVP省令への適合
- 製造販売業者は、製造販売している製品について、安全性を確保するために、法(GVP省令)に定
める基準に従って、製造販売後安全管理に関する業務を行う必要があります。
- (1)GVP省令とは
- 「医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関
する省令(平成16年厚生労働省令第135号)」(全5章16条)という、医薬品(原薬を除く)等
の製造販売後安全管理に関する基準で、製造 販売業の許可要件として制定された厚生労働省令
です。「GVP(Good Vigilance Practice)省令」と略称します。
- 医薬品等の製造販売をするにあたり、製造販売後に必要となる安全管理として、以下のような安
全管理情報(医薬品等の品質・有効性・安全性に関する事項、その他医薬品等の適正な使用のた
めの情報)の収集、検討、手順書等に基づく安全確保措置の実施手順について規定しています。
(ア)安全管理情報の収集業務(副作用・有害作用など安全性に関する情報を消費者や販売店、
業界団体や文献、行政等からの収集ルール)。
(イ)情報の検討と安全確保措置の立案業務(表示や使用上の注意の変更、国への報告や回収・
廃棄等の検討・立案ルール)。
(ウ)安全確保措置の実施(表示や使用上の注意の変更、国への報告や回収・廃棄等の対応措置
の実施ルール)。
(エ)文書や記録の管理(保存方法や保存年限、改訂履歴等のルール)。
(オ)品質部門と安全部門あるいは営業部門など各部門との連携等。
<2-3> 人的要件・その他の順守事項
- (1)人的要件
- (ア)申請者の欠格要件
- 申請者(法人であるときは、化粧品の製造販売に関する業務を行う役員)は、医薬品医療機
器等法第12条の2(同第5条第3号を準用)に定める申請者の欠格要件である、下記(a)から
(f)に該当しないこと。
- (a)法第75条第1項の規定により許可を取り消され、取り消しの日から3年を経過していな
い者。
(b)法第75条の2第1項の規定により登録を取り消され、取り消しの日から3年を経過してい
ない者。
(c)禁錮以上の刑に処せられ、その執行を終わり、又は執行を受けることがなくなった後、
3年を経過していない者。
(d)(a)から(c)までに該当する者を除くほか、この法律、麻薬及び向精神薬取締法、
毒物及び劇物取締法その他薬事に関する法令で政令で定めるもの又はこれに基づく処分に
違反し、その違反行為があった日から2年を経過していない者。
(e)成年被後見人又は麻薬、大麻、あへん若しくは覚醒剤の中毒者。
(f)精神の機能の障がいにより医療機器製造業の業務を適正に行うにあたって必要な認知、
判断及び意思疎通を適切に行うことができない者。
(医薬品医療機器等法第12条の2、同第5条第3号を準用より)
- (イ)総括製造販売責任者の設置・資格要件
- 化粧品の製造販売業者はGQP省令、GVP省令で求める業務を遂行するために、厚生労働省令
で定める基準に該当する者を、総括製造販売責任者として設置しなければなりません。
(医薬品医療機器等法第17条第1項より)
- <総括製造販売責任者の資格要件>
- 医薬品医療機器等法第17条第1項に規定する化粧品の製造版業の総括製造販売責任者は、
次の各号のいずれかに該当する者でなければなりません。
(a)薬剤師。
(b)旧大学令(大正7勅令第388号)に基づく大学、旧専門学校令(明治36年勅令第61号)
に基づく専門学校又は学校教育法(昭和22年法律第26号)に基づく大学若しくは高等専
門学校(以下「大学等」という。)で、薬学又は化学に関する専門の課程を修了した者。
(c)旧中等学校令(昭和18年勅令第36号)に基づく中等学校(以下「旧制中学」という)
若しくは学校教育法に基づく高等学校(以下「高校」という。)又はこれと同等以上の学
校で、薬学又は化学に関する専門の課程を修了した後、医薬品又は医薬部外品の品質管理
又は製造販売後安全管理に関する業務に3年以上従事した者。
(d)厚生労働大臣が前2号に掲げる者と同等以上の知識経験を有すると認めた者。
(医薬品医療機器等法施行規則第85条第1項1号から4号より)
- <化粧品の品質管理及び販売後安全管理を行う者の資格要件>
- 化粧品の製造販売業者は、GQP省令、GVP省令で求める業務の遂行にあたり、品質管理及び製
造販売後安全管理を行う者は、厚生労働省令で定める基準により、次の各号のいずれかに該当
する必要があります。
- (a)薬剤師。
(b)旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する専門の課程
を修了した者。
(c)旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する科目を修得
した後、医薬品、医薬部外品又は化粧品の品質管理又は製造販売後安全管理に関する業務
に三年以上従事した者。
(d)厚生労働大臣が前3号に掲げる者と同等以上の知識経験を有すると認めた者。
(医薬品医療機器等法施行規則第85条第2項1号から4号より)
-
- (2)消費者への情報提供
- 消費者の問い合わせに対して的確な情報提供ができる体制を整備する必要があります。
(ア)問い合わせ先の公表。
(イ)相談窓口の設置。
(ウ)製品に関する情報の管理。
(平成12年9月29日医薬発第990号、平成13年3月6日医薬審発第163号・医薬監麻発第
220号通知より)
-
- (3)回収の報告
- 製造販売した医薬部外品の自主回収に着手したときは、速やかに製造販売業許可権者あてに法で
定める事項を報告しなければなりません。
(詳細は、「医療機器の許認可について <2-2> 人的要件・その他の順守事項(3)回収
(改修)について」を参照。)
(医薬品医療機器等法第68条の11、同規則第228条の22)
<2-4> 化粧品等製造販売業許可の申請手続き要領
(以下、東京都、兵庫県の参考事例を記載)
1.化粧品製造販売業許可申請
書
|
備 考 |
(1)提出先、申請先及び問合
せ先
|
<東京都庁>
健康安全研究センター 広域監視部 薬事監視指導課 医薬品審査係
〒169-0073 東京都新宿区百人町3-24-1 本館1階
電話 03-5937-1029
<兵庫県庁>
農政環境部 環境管理局 環境整備課 廃棄物適正処理班
〒650-8567 兵庫県神戸市中央区下山手通5丁目10番1号
TEL 078-362-3281
|
(2)様式
|
FD申請ソフトによる。
|
(3)受付期間、時間
|
月曜日から金曜日(祝日、年末年始を除く)
午前9時から午前11時30分まで
|
(4)提出部数
|
1部(申込控え 1部)、郵送不可
|
(5)手数料
|
化粧品製造販売業許可申請 57,400円
|
(6)実地調査
|
製造販売業:「GQP」・「GVP」に適合していることの確認。
|
(7)許可証交付
|
許可証の交付については、下記の方法のどちらかを選択。
①許可証が出来上がった旨をはがきで通知をし、窓口で受け取る。
②レターパック又は、450円分の切手(簡易書留での送付)を貼
った角2型(A4サイズを折らずに入る大きさ)に宛先を明記した
ものを持参し、郵送で受け取る。
|
(8)標準的事務処理期間
|
35日 (土日祝日、年末年始を除く)
|
2.添付書類
|
|
(ア)登記事項証明書
|
法人の場合 発行後6か月以内のもの。
|
(イ)業務分掌表
|
法人における「業務を行う役員」の範囲を具体的に示す書類。
※役員全員が「業務を行う役員」に該当する場合は添付不要。
※役員のうち、「業務を行う役員」に該当しない者は、その具体
的な業務内容を追記。
(例:人事担当、総務担当など。役職名や部署名など業務内容とは
いえないものは不可。)
|
(ウ)申請者の医師の診断書
|
発行後3か月以内のもの。
法人の場合は業務を行う役員について、「精神機能の障害又は麻
薬、大麻、あへん若しくは覚醒剤の中毒者でない」旨の診断書。
※「業務を行う役員」のうち、以下の条件を満たす者は、診断書
の代わりに疎明書でも可。
(1)海外在住であること。
(2)薬事に関する意思決定に直接関与しない。
|
(エ)当該製造販売業の許可証
の写し
|
申請者が現に製造販売業の許可を受けている場合。
|
| (オ)組織図 |
法人の場合 。
|
(カ)総括製造販売責任者の雇
用契約書の写しまたは雇用関係
を証する書類
|
※休日は具体的に記入。
(例:土曜・日曜・祝祭日、「会社の定める日」など、客観的に
勤務状況がわからない記載は不可。)
|
(キ)総括製造販売責任者の資
格を証する書類
|
(1)薬剤師・・・薬剤師免許証原本提示。
(2)医薬品医療機器等法施行規則第85条第2項第2号に該当・・
・卒業証書の写し(本証提示)又は卒業証明書、専門の課程であることが明らかな学科名でない場合は単位取得証明書。
(3)医薬品医療機器等法施行規則第85条第2項第3号に該当・・
・単位取得証明書及び従事年数証明書。
|
(ク)品質管理に係る体制に関
する書類
|
(GQP体制図)
|
(ケ)製造販売後安全管理に係
る体制に関する書類
|
(GVP体制図)
|
(コ)配置図
|
同一敷地又は建物における、自社と他社使用部分を明示したもの。
|
(サ)事務所の平面図
|
製造販売業として使用するフロアの図面
参考として、総括製造販売責任者の座席を明示。
|
(シ)保管設備に関する図面
|
市場への出荷可否判定(※)のために、製造販売業者の事務所内
で製品を保管する場合(市場への出荷可否判定を製造業者に委託
しない場合)。
(出荷判定概略図)
|
(ス)事務所の案内図
|
最寄りの駅から事務所までの地図を添付。
|
※更新について
|
化粧品の製造販売業の許可は、5年ごとにその更新を受ける必要が
あります。
|
3.化粧品の製造販売を始める前に
- (1)目的、効能・効果の確認
- 製造販売しようとする製品が、化粧品の使用目的(医薬品医療機器等法が定めるもの)のほかに
人又は動物の疾病の診断・治療又は予防、身体の構造又は機能に影響を及ぼすことを併せて目的
としているものや、医薬部外品に該当するものは、化粧品ではなく、医薬品や医薬部外品に該当
します。製造販売しようとする製品が、化粧品に該当するものか、その目的、効能・効果を確認
する必要があります。
(「医薬品等適正広告基準」(昭和55年10月9日 薬発第1339号)、「化粧品の効能の範囲の
改正について」(平成23年7月21日 薬食発0721第1号)等参照)
-
- (2)化粧品成分の確認
- 化粧品の成分は、「化粧品基準」(平成12年厚生省告示第331号)に適合したものを使用の上、
製品にすべての配合成分を表示する必要があります。
(「化粧品基準」(平成12年厚生省告示第331号)参照)
-
- (3)製造販売届書等の提出
- 化粧品を製造販売する場合には、製造販売許可をは別に、あらかじめ製品ごとに製造販売届書を
提出する必要があります。
なお、外国から輸入する製品の場合は、製造販売届書、化粧品外国届書を提出する必要がありま
す。
(「1.(3)製造販売の届出」、「1.(4)化粧品の輸入手続き」を参照。)
-
- (4)品質標準書の作成
- 製造販売しようとする化粧品についてはその内容を明らかにするために、個別の製品ごとに以下
の事項を記載した「品質標準書」を作成します。
- (ア)販売名(シリーズ製品の場合には、色又は香の識別に関する部分を付記)
(イ)製造販売の届出年月日、輸入届年月日
(ウ)効能効果(化粧品の範囲を超えないこと)
(エ)用法用量又は使用方法、使用上の注意
(オ)原料の名称、規格及び配合量(標準的仕込量)
(カ)委託製造所の名称、所在地及び許可番号(外国製造所の場合は、届出事項等)
(キ)製造方法
(ク)試験検査所の名称、所在地
(ケ)製品規格及び試験検査方法
(コ)容器、包装形態及び表示内容(容器、表示資材等の規格を含む。)
(サ)保管条件及び取扱い上の注意事項
(シ)製造業者との取り決め内容
(ス)出荷判定基準
(セ)その他必要な事項
(ソ)制定者
(タ)改訂者、改訂年月日、改訂事項及び改訂理由
-
- (5)化粧品の表示
- 医薬品医療機器等法は、化粧品の表示(法定表示)について定めています。
化粧品には購入された方に分かりやすいように、化粧品が直接入っているビンや箱(直接の容器
又は直接の被包)に、販売名や製造販売業者、ロット番号など製品に関する情報の表示が必要で
す。
(医薬品医療機器等法第61条より)
- 化粧品の表示にあたって注意する事項は以下のとおりです。
- (ア)化粧品を箱などに入れて販売するときの注意点(医薬品医療機器等法第62条で準用する
同法第51条参照)
(イ)化粧品を箱などに入れて販売するときの注意点(「化粧品の全成分表示の表示方法につ
いて」(平成13年3月6日付医薬審発第163号/医薬監麻発第220号))
(ウ)全成分の表示方法及び特例(医薬品医療機器等法施行規則第221条の2(化粧品に関する
表示の特例))
(エ)製造専用(製造販売業者又は製造業者への販売)の表示(医薬品医療機器等法施行規則
第221条の3で準用する同法第214条(製造専用化粧品に関する表示の特例) )
(オ)小さい容器に入っている化粧品の表示の特例(規則第221条の3で準用する規則第211条
第1項、第2項)
- この他に、化粧品の表示については、医薬品医療機器等法とは別に、医薬品医療機器等法以外の
法令による化粧品の表示の規制として、容器包装リサイクル法や公正競争規約により要求されて
いる事項があります。
(「化粧品の表示に関する公正競争規約」、「化粧石けんの表示に関する公正競争規約」、「歯
みがき類の表示に関する公正競争規約」等参照)
4.化粧品の製造業の許可要件
- 医療機器等の製造販売業許可取得の要件は、以下の2つです。
<4-1> 「薬局等構造設備規制」への適合
<4-2> 人的要件・その他の順守事項
許認可の申請手続きの要領は、以下を参照ください。
<4-3> 化粧品製造業許可の申請手続き要領
<4-1> 「薬局等構造設備規則」への適合
- (1)「薬局等構造設備規則」とは
- 薬局等構造設備規則(昭和36年2月1日厚生省令第2号)は、医薬品医療機器等法(第6条第1号
第26条第2項、第13条第2項第1号、第23条、第28条第3項第1号、第39条第2項)に基づいて、
薬局、医薬品・医療機器の販売業、医薬品・医薬部外品・化粧品・医療機器の製造所等の構造設
備について個別の基準を定めた厚生労働省令です。
- 薬局、医薬品販売業、医療機器販売業・賃貸業などの小売業、及び医薬品、医薬部外品、化粧品
医療機器の製造業、医療機器の修理業がその規制対象になります。薬局、医薬品・医療機器の販
売業、医薬品・医薬部外品・化粧品・医療機器の製造所等の構造設備については、必要な設備及
び器具を備えていることの具体的な要件が異なるため、製造区分により適用条文が異なります。
-
- (2)化粧品製造所の構造設備について
- 化粧品の製造所は、「薬局等構造設備規制」に適合していることが、化粧品の製造業の許可要件
です。
- 化粧品の製造所の製造所については、実際に器具,機械等を用いて化粧品の製造工程の全部又は
一部を行う製造区分(一般区分)の構造設備については同規則第13条が、また製品への表示作業
包装作業,出荷前の製品の保管等の区分(包装、表示、保管区分)の構造設備については同規則
第13条の2が、それぞれ具体的な要件を定めています。
なお、製造所の建替え・引越しは、「業許可申請」が、設備の変更は「変更届書」が」それぞれ
必要になります。
(薬局等構造設備規則第13条、同第13条の2より)
<4-2> 人的要件・その他の順守事項
- (1)人的要件
- (ア)申請者の欠格要件
- 申請者(法人であるときは、化粧品の製造に関する業務を行う役員)の欠格要件は、医薬品医
療機器等法第13条第4項第2号(同第5条第3号を準用)により定めますが、その内容は前記の
医療機器等の製造販売業許可におけるものと同じです。
(「医療機器等の許認可 <2-3> (1)(ア)申請者の欠格要件」を参照。)
(医薬品医療機器等法第13条第4項第2号、同第5条第3号を準用より)
-
- (イ)責任技術者の資格
- 化粧品製造業の製造所には、責任技術者を設置しなければなりません。
(医薬品医療機器等法第17条第5項)
- <責任技術者の資格要件>
- 医薬品医療機器等法第17条第5項に規定する化粧品の製造所の責任技術者は、次の各号のいず
れかに該当する者でなければならない。
(a)薬剤師。
(b)旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する専門の課
程を修了した者。
(c)旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する科目を修得
した後、医薬品、医薬部外品又は化粧品の製造に関する業務に3年以上従事した者
(d)厚生労働大臣が前三号に掲げる者と同等以上の知識経験を有すると認めた者
(医薬品医療機器等法施行規則第91条)
-
- (2)申請する許可区分の検討
- 化粧品の製造業の許可区分は以下のとおりです。製造工程を検討し、どの許可区分の申請が必要
か決定してください。その際、その製造区分に適合するように構造設備を整備することが必要で
す。
(「<4-1>(2)化粧品製造所の構造設備について」参照)
-
- (3)記録の作成等
- 製造記録・試験記録・その他製造所の管理に関する記録を作成し、3年間(または、有効期間
+1年のうち長い期間)保管することが求められています。
ただし、薬事に関する他の法令等(「GQP省令」等)で、記録の作成・保存が義務づけられてい
る場合は、そちらにも従う必要があります。
(医薬品医療機器等法施行規則第90条より)
-
- (4)許可証の掲示
- 製造業の許可証(原本)は、製造所の見やすい場所に掲示しなければなりません。
(医薬品医療機器等法施行規則第114条第2項で準用する同規則第3条より)
<4-3> 化粧品製造業許可の申請手続き要領
(以下、東京都、兵庫県の参考事例を記載)
1.化粧品製造販売業許可申請
書
|
|
(1)提出先、申請先及び問合
せ先
|
<東京都庁>
健康安全研究センター 広域監視部 薬事監視指導課 医薬品審
査係
東京都新宿区百人町3-24-1 本館1階
電話 03-5937-1029)
<兵庫県庁>
農政環境部 環境管理局 環境整備課 廃棄物適正処理班
〒650-8567 兵庫県神戸市中央区下山手通5丁目10番1号
TEL 078-362-3281
|
(2)様式
|
FD申請ソフトによる。
|
(3)受付期間、時間
|
月曜日から金曜日(祝日、年末年始を除く)
午前9時から午前11時30分まで
|
(4)提出部数
|
1部(申込控え 1部)、郵送不可
|
(5)手数料
|
化粧品製造業許可申請(許可区分:包装・表示・保管)
32,800円 現金
化粧品製造業許可申請(許可区分:一般) 39,000円 現金
|
(6)実地調査
|
製造販売業:「GQP」・「GVP」に適合していることの確認を行
います。
|
(7)許可証交付
|
許可証の交付については、下記の方法のどちらかを選択してくださ
い
①許可証が出来上がった旨をはがきで通知をし、窓口で受け取る。
②レターパック又は、450円分の切手(簡易書留での送付)を貼っ
た角2型(A4サイズを折らずに入る大きさ)に宛先を明記したも
のを持参し、郵送で受け取る。
|
(8)標準的事務処理期間
|
35日 (土日祝日、年末年始を除く)。
|
2.添付書類
|
|
(ア)登記事項証明書
|
法人の場合 発行後6か月以内のもの。
|
(イ)業務分掌表
|
法人における「業務を行う役員」の範囲を具体的に示す書類 。
※役員全員が「業務を行う役員」に該当する場合は添付不要。
※役員のうち、「業務を行う役員」に該当しない者は、その具体的
な業務内容を追記。(例:人事担当、総務担当など。役職名や部署
名など業務内容とはいえないものは不可。)
|
(ウ)申請者の医師の診断書
|
発行後3か月以内のもの。
法人の場合は業務を行う役員について、「精神機能の障害又は麻薬
、大麻、あへん若しくは覚醒剤の中毒者でない」旨の診断書。
※「業務を行う役員」のうち、以下の条件を満たす者は、診断書の
代わりに疎明書でも可。
(1)海外在住であること。
(2)薬事に関する意思決定に直接関与しない。
|
(エ)責任技術者の雇用契約書
の写しまたは雇用関係を証する
書類
|
※休日は具体的に記入してください。
(例:土曜・日曜・祝祭日、「会社の定める日」など、客観的に勤
務状況がわからない記載は不可。)
|
(オ)責任技術者の資格を証す
る書類
|
(1)薬剤師・・・薬剤師免許証原本提示。
(2)医薬品医療機器等法施行規則第91条第2項第2号に該当・・
・卒業証書の写し(本証提示)又は卒業証明書、専門の課程である
ことが明らかな学科名でない場合は単位取得証明書。
(3)医薬品医療機器等法施行規則第91条第2項第3号に該当に該
当・・・単位取得証明書及び従事年数証明書。
(4)医薬品医療機器等法施行規則第91条第2項第4号に該当・・
・従事年数証明書。
|
(カ)構造設備の概要一覧表
|
※平成22年10月13日 薬食発1013第2号
「医薬品等の製造業の許可及び外国製造業者の申請書に添付する様
式等の改正について」を参照。
|
(キ)製造設備器具一覧表
|
|
(ク)試験検査器具一覧表
|
|
(ケ)他の試験検査機関等の利
用概要及び契約書の写し又は利
用証明書
|
他の試験検査機関を利用する場合。
(他の試験検査機関等の利用概要)
|
(コ)製造所の配置図
|
同一敷地内の建物及び建物内の自社と他社の使用部分を示したもの
|
| (サ)製造所の平面図 |
保管場所として棚を利用する場合は、その立面図も添付。
|
(シ)製造しようとする品目の
一覧表及び代表一品目の製造工
程に関する書類
|
|
(ス)製造所の案内図
|
|
※更新について
|
化粧品の製造業の許可は、5年ごとにその更新を受ける必要があり
ます。
|


